Cobertura COVID-19 en Noticias RPP (20 de mayo 2020)
"Tratamiento con plasma rico en anticuerpos es uno de los más prometedores"
El asesor médico de RPP, Elmer Huerta manifestó que el Perú tiene un alto índice de pacientes recuperados por COVID-19, estos podrían ser aprovechados para elaborar tratamientos con plasma y evitar nuevos decesos. Escuchar playlist en RPP: 4 audios
Fármacos: La mitad de todos los nuevos ingredientes activos son de origen transgénico
Ayer miedo, hoy rutina
Artículo original en transparenz GENTECHNIK (28 Feb 2020), de Alemania
Desde que la Unión Europea (UE) introdujo un proceso centralizado para la aprobación de medicamentos generados utilizando organismos genéticamente modificados en 1995, se han aprobado 280 de este tipo de medicamentos, los cuales en el caso de Alemania contienen 232 distintos ingredientes activos. Tan solo en 2018 se agregaron 38 nuevos ingredientes activos a esta lista, la cual sigue creciendo de manera notable. Actualmente, el dos por ciento de todos los ingredientes activos se producen utilizando microorganismos genéticamente modificados o cultivos celulares. La proporción de medicamentos derh1ivados de la ingeniería genética suman ya el cincuenta por ciento de todas las nuevas aprobaciones. Según la Asociación de Fabricantes de Fármacos que hacen su propia investigación, casi la mitad de todos los nuevos ingredientes activos se fabrica mediante procesos de ingeniería química-sintética y genética, mientras que las sustancias naturales y las sustancias activas semisintéticas juegan un rol mucho menor.
Las ventas de productos farmacéuticos de origen transgénico aumentaron casi en un 12 por ciento en 2018, llegando a 11’400 millones de euros. Esto corresponde a una participación del 27 por ciento del total del mercado farmacéutico. Los biosimilares, que son réplicas de productos farmacéuticos originales comercializados después de que expirasen sus patentes, lo que los hace más baratos, también lograron un fuerte crecimiento en las ventas.
Los campos de aplicación de los medicamentos de origen transgénico, también conocidos como biofármacos o biológicos, son principalmente diversas enfermedades autoinmunes, como la esclerosis múltiple o el reumatismo, pero también diabetes, osteoporosis, leucemia y otros tipos de cáncer, así como trastornos metabólicos y de coagulación congénitos. Un sinnúmero de vacunas importantes también es de origen transgénico, entre ellas vacunas contra la hepatitis B, el cáncer cervical, el tétanos, la difteria o la meningitis (meningococos), el cólera, la gripe y los virus del papiloma (desencadenantes del cáncer cervical y otras enfermedades). Una vacuna de origen transgénico contra el ébola también está en proceso de aprobación.
Los cultivos celulares se utilizan principalmente como organismos de producción y constan principalmente de líneas celulares provenientes de hámsteres o ratones, pero también células de origen humano. La bacteria de Escherichia coli genéticamente modificada y varias cepas de levadura son utilizadas en numerosas plantas de producción para producir una serie de ingredientes activos. Dos ingredientes activos aprobados provienen incluso de animales transgénicos: cabras producen un ingrediente activo (Atryn) para la prevención de la trombosis; conejos producen un ingrediente contra el angioedema hereditario, una enfermedad hereditaria rara. Cuarenta y tres de las aprobaciones consisten en anticuerpos especializados y proteínas de gran tamaño luego utilizadas por las células del sistema inmune para etiquetar ciertas moléculas (antígenos) y que han resultado en terapias mejoradas contra distintos tipos de cáncer.
Las sustancias activas aprobadas en Alemania se producen principalmente en los Estados Unidos. Hay al menos 45 plantas de ingeniería genética en Alemania, unas 100 en los demás países de la UE, pero también en Singapur, India, Japón y otros países no europeos.
En 2018 había alrededor de 400 empresas en el sector de biotecnología médica en Alemania. Una buena parte de ellos ya comercializa productos biofarmacéuticos o los tiene en su cartera de productos. Más de 600 ingredientes activos y productos de compañías que operan en Alemania están en desarrollo clínico.
Hoy en día, este tipo de medicamentos, tanto para médicos como para pacientes, son cuestión de rutina. Ya no hay reservas fundamentales sobre el método de fabricación, es decir su origen transgénico, en Alemania. Hace veinte años la cosa era distinta. Los críticos de la ingeniería genética cuestionaban no solo los beneficios y la eficacia de los medicamentos genéticamente modificados, sino también la seguridad de las instalaciones de producción. Temían que los microorganismos genéticamente modificados podrían escapar al medio ambiente y transmitir sus genes introducidos, provocando así daños irreversibles, los cuales sin embargo nunca pudieron definir. Los grupos verdes y muchas organizaciones ambientales incluso pidieron una prohibición total de la ingeniería genética.
No fue sino hasta 1998, catorce años después de la primera aplicación, que una planta para la producción de insulina humana comenzó a operar en Frankfurt. Largas discusiones e interminables pesquisas y reportes sobre el así llamado "riesgo residual" retrasaron el inicio de las operaciones, luego de concluir una y otra vez que no existían tales riesgos percibidos. Hoy, 22 ingredientes activos de origen transgénico han sido aprobados en Alemania, doce de los cuales se fabrican en Dinamarca, cinco en los Estados Unidos y seis en Alemania.
La biología molecular y las tecnologías de producción han evolucionado desde que se introdujeron los primeros ingredientes de origen transgénico como la insulina o la hormona renal eritropoyetina (EPO). A diferencia de los medicamentos simples, los biofármacos actuales son macromoléculas grandes y complejas que constan de 20,000 átomos o más y que deben asumir una estructura tridimensional específica para lograr el efecto deseado. Solo gracias a la biotecnología moderna ha sido posible fabricar tales medicamentos manteniendo una calidad alta y constante, con la ayuda de cultivos celulares, levaduras o bacterias modificadas específicamente para este propósito.
La simple ingeniería genética de la década de 1990 (aislar un gen para producir un ingrediente activo y transferirlo a un organismo de producción) ya no es suficiente. Hoy se utilizan programas de computadora para encontrar sustancias con propiedades definidas con alta precisión, para luego generar el código genético necesario y luego transferir dicho gen sintético a microorganismos o células adecuadas. Además, en la actualidad la biología sintética ha llegado al punto en que investigadores pueden diseñar nuevas rutas metabólicas que conduzcan a los ingredientes activos deseados, para luego transferirlos implementar estas rutas en sistemas biológicos adecuados.
A un paso de controlar la malaria
Una nueva técnica transgénica hace colapsar poblaciones de zancudos
Un reciente artículo publicado en la revista Nature por un grupo de investigadores de Inglaterra, Italia y Estados Unidos reporta sobre una nueva técnica que ofrece una posible solución al problema de la malaria. La técnica consiste en incorporas en los zancudos machos un gen que resulta en una población compuesta principalmente por zancudos machos y que por lo tanto conlleva al colapso de las poblaciones de zancudos que lleven este gen.
La malaria mata a más de un millón de personas al año a nivel mundial, en su mayoría niños menores de 15 (el 65%), quienes son los más susceptibles a esta enfermedad. Otros 200 mil mueren como infantes cuando las madres contraen malaria. Alrededor de 500 millones de personas padecen de malaria crónica, lo que resulta en incapacitación, pérdidas económicas y una carga adicional para las familias usualmente pobres y afectadas por este flagelo de la humanidad.
La malaria es causada por un parásito que utiliza a ciertas especies de mosquito como vectores para pasar de un ser humano a otro con la sangre que los mosquitos hembras chupan, y que estos mosquitos requiere como fuente de nutrición para su propia reproducción. Los principales vectores de la malaria en África son los mosquitos Anopheles funestus; y Anopheles gambiae.

Un mosquito del género Anopheles, vector de la malaria. Las hembras requieren de la sangre humana para nutrir a la siguiente generación. El parásito de la malaria, un protozoario del género Plasmodium, depende del mosquito para cumplir su ciclo reproductivo, pasando de persona a persona gracias al vector.
Aunque después de grandes inversiones y muchos esfuerzos internacionales se han logrado ciertos avances en la creación de una vacuna contra la malaria, ésta se mantiene elusiva, y por lo tanto es urgente la búsqueda de soluciones alternativas.
La repartición de mosquiteros impregnados con DDT ha tenido buenos resultados, donde éstos han sido distribuidos. Pero mientras los vectores sigan presentes, será muy difícil erradicar la enfermedad, ya que ésta puede rebrotar en cualquier momento.
La nueva técnica, desarrollada en el Imperial College de Londres, se basa en la inyección de un gen, cuya función lleva a que la gran mayoría de la descendencia esté constituida por mosquitos machos, que además no pican, lo que lleva a la reducción de la población femenina a tal punto que puede acabar con una población en el plazo de seis generaciones.
Al desaparecer los vectores es muy probable que también desaparezca el microorganismo causante de la malaria, protozoarios del género Plasmodium, por falta de hospedero esencial en su complejo ciclo reproductivo. Para lograr esta meta es necesario trabajar con amplia cobertura, para así evitar que nuevas poblaciones de vectores y parásitos se desplacen a las zonas ya tratadas. De esta manera se podría interrumpir completamente el ciclo reproductivo, ya que el parásito depende de los mosquitos, y los mosquitos dependen de la sangre humana.
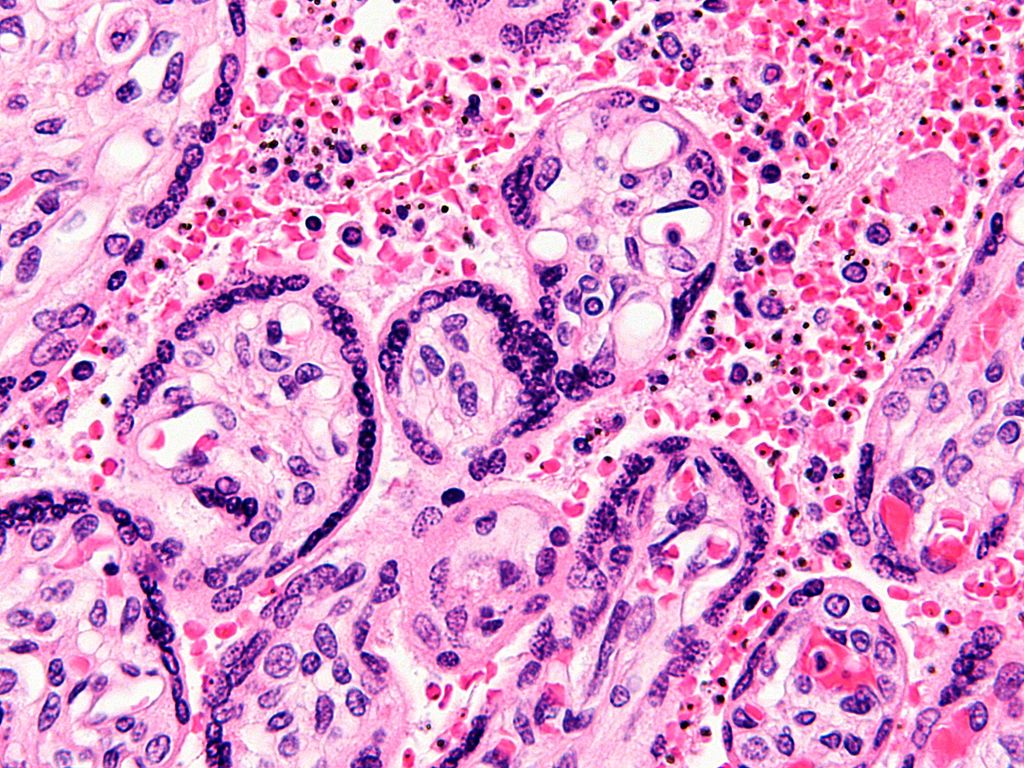
Placenta con malaria materna: Los eritrocitos o glóbulos rojos afectados por malaria son las células rojas con un cuerpo oscuro dentro de ellas, el parárasito causante de la malaria. Los eritrocitos sanos no tienen núcleo.
Los investigadores inyectaron un gen encontrado en un moho. Se trata de una endocucleasa homing (un tipo de enzima de restricción) llamada I-Ppol. Cuando esta nucleasa está presente en un cromosoma X causa su ruptura.
El cromosoma X es un cromosoma sexual. En muchos organismos el macho de una especie posee un cromosoma X y un Y, mientras que las hembras llevan dos cromosomas X. En la reproducción sexual es prácticamente el macho quien decide si la cría será hembra o macho, ya que el espermatozoide lleva sólo un cromosoma X o Y. Si los cromosomas X que lleva el espermatozoide son defectuosos, la fecundación sólo podrá producir descendencia masculina.
La técnica funciona en un sistema cerrado. En la actualidad se están llevando a cabo los preparativos para hacer los primeros experimentos de campo, los que se espera demostrarán que la técnica también funciona en un sistema natural. Experimentos de campo con enfoques similares han producido resultados prometedores recientemente.
A menudo los organismos evaden mecanismos de resistencia por medio de mutaciones, pero les queda más difícil lograrlo si la resistencia es comepleja. En este caso el gen utilizado está presente en múltiples copias, lo que eleva la probabilidad de que el mosquito no sea capaz de desarrollar mecanismos alternos para evadir el efecto de la nucleasa.
Fuente: Galizi et al (2014) A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications 5, Article number: 3977 doi:10.1038/ncomms4977
Revolución biotecnológica en la medicina
Producción de sustancias terapéuticas
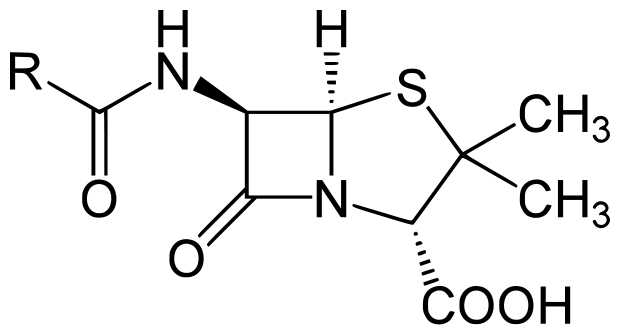
Muchas sustancias terapéuticas se obtienen a partir de microorganismos; por ejemplo, la penicilina. Un gran número de estas sustancias se producen hoy gracias a la biotecnología, como la insulina. Las personas que sufren diabetes deben inyectarse insulina varias veces al día. Hasta el año 1983, la insulina que utilizaban las personas diabéticas era insulina de cerdo purificada. Desde el año 1982 se comercializa insulina obtenida mediante ingeniería genética, siendo ésta la primera molécula biológica fabricada por esta técnica y comercializada.
Otras sustancias se obtienen a partir de plantas y animales transgénicos, como el factor VIII, que interviene en la coagulación de la sangre. Asimismo, la ingeniería genética permite producir hormonas humanas en cantidades suficientes para tratar muchas enfermedades carenciales. Por ejemplo, el enanismo producido por déficit de la hormona del crecimiento. Al principio se trataba a las personas enfermas con hormona extraída de la hipófisis de cadáveres. Actualmente, la hormona del crecimiento es fabricada por bacterias. Un recipiente con 500 litros de bacterias puede producir tanta cantidad de hormona como 35.000 hipófisis humanas.
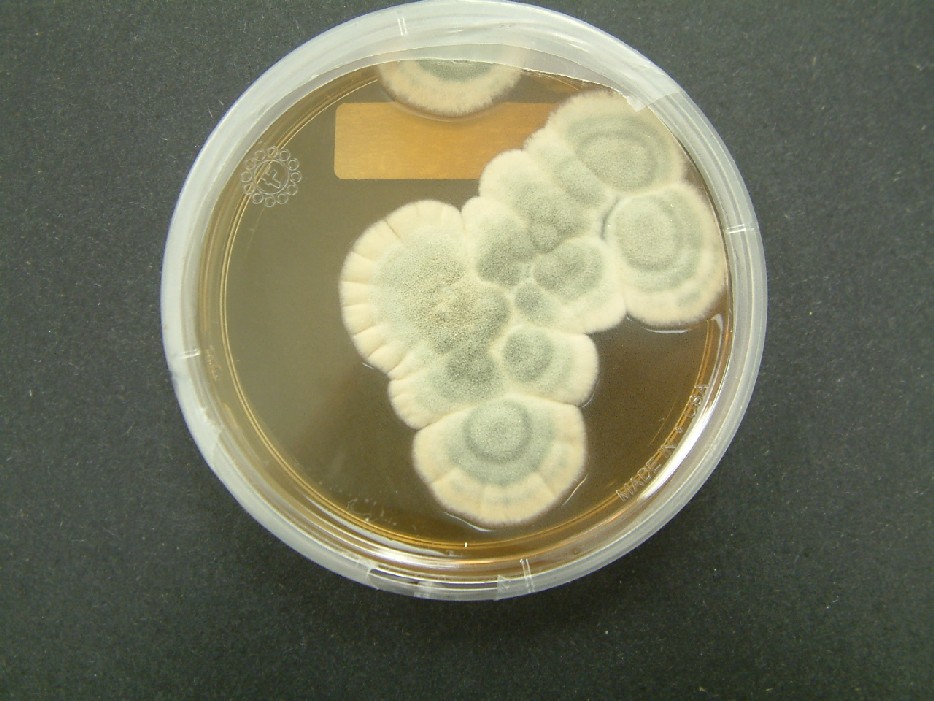 | |
 | La penicilina es producida por el hongo Penicillium chrysogenum (antes P. notatum). En la naturaleza el hongo produce alrededor de 2 miligramos de penicilina por litro. Gracias a la biotecnología el hongo es capaz de producir 60 gramos por litro en tanques de fermentación hoy en día. |
Cura contra el SIDA podrá ser producida en plantas
Anticuerpos monoclonales de alto grado de pureza producidos en hojas de tabaco
PHARMA-PLANTA – Harnessing plant biotechnology to revolutionise pharmaceutical production
(Publicado el 18 de junio del 2012 en la sección Investigación e Innovación de la Unión Europea)
Se trata de un proyecto en el cual participan numerosos países (Holanda, Alemania, Francia, Italia, Bélgica, España, Suecia, Reino Unido, Austria, Grecia, Suiza y Sudáfrica). El proyecto, cuya primera fase culminó en octubre del 2011, representa un costo total de 17,600,000 €.
(Sigue artículo original en inglés)
In June 2011, medical regulators gave the go-ahead for trials in humans of a potential new anti-HIV drug. The drug was produced in genetically modified tobacco leaves. It was the first ever clinical trial of a drug of this type that had been derived from GM plants.
The hope is that the drug will prove effective in preventing HIV infection. But the real significance of the regulatory green light, given by the UK's licensing body, the Medicines and Healthcare products Regulatory Agency (MHRA), went further than that.
It confirmed, for the first time, that molecules known as monoclonal antibodies – the key component of the drug, and of many other highly effective modern pharmaceuticals - could be produced from plants in a form that met the extremely stringent standards required for use in the treatment of humans. As well as bringing hope to the fight against HIV/AIDS, the decision opened the way for trials of other plant-derived medicines to treat a range of diseases.
It was, potentially, an important step towards the transformation of modern drug manufacturing, offering the developing world access to key drugs which have previously been prohibitively costly.

The move to Phase 1 clinical trials was the crowning achievement of PHARMA-PLANTA, a seven-and-a-half year EU-funded project set up in 2004. With € 12 million of funding provided under the EU's 6th Framework Programme of research and development, the PHARMA-PLANTA consortium comprised more than 30 academic and industrial partners from across Europe and South Africa. The consortium's goal was clearly stated: to develop a manufacturing process for recombinant protein drug products derived from GM plants and to take one such product through all the development stages, including clinical trial.
The approval from the MHRA was described by the project's scientific co-ordinator, Professor Julian Ma of St. George's, University of London, as "a red letter day". It was, he said, "an acknowledgement that monoclonal antibodies can be made in plants to the same quality as those made using existing conventional production systems. That is something many people did not believe could be achieved."
The conventional production systems referred to by Professor Ma use sophisticated stainless steel fermentation vats containing bacteria or mammalian cells. The process of deriving antibodies from these cells is high-tech - and highly expensive.
By contrast, the antibodies produced by PHARMA-PLANTA were derived from tobacco plants grown in greenhouses in Germany, harvested after 45 days and shredded. According to Professor Rainer Fischer, Director of the institute where the GM tobacco was grown, this much simpler, more low-tech option is between 10 and 100 times cheaper.
Just as importantly, the simplicity of the process means it could easily be transferred to developing countries, allowing production of drugs "in the region, for the region."
Discovered by one of the four private commercial partners in the project, Austrian biotech company Polymun, the new antibody successfully completed its Phase 1 trial, ascertaining its safety, at the end of 2011. It is now set to move into the next phase of testing, to establish its medical effectiveness.
Meanwhile, other diseases for which it is envisaged that GM plants could provide new drugs include cancer, rheumatoid arthritis and others which, in the words of Professor Ma, are currently "horribly expensive" to treat.
As Professor Fischer explains, the success of PHARMA-PLANTA "is a springboard for European plant biotechnology and will enable many important medical products to be realised".
Medicina incorporada en el genoma humano
Terapia génica
La terapia génica consiste en la introducción de genes en seres humanos con el fin de corregir alguna enfermedad de origen genético. Hasta hace poco tiempo la única forma de tratar ciertas enfermedades consistía en suministrar sustancias que actuaban sobre las consecuencias de la afección, no sobre el origen. Mediante la terapia génica se puede silenciar un gen defectuoso o se puede complementar la acción de un gen que o no produce el producto adecuado o no lo produce del todo.
En la actualidad se están desarrollando tratamientos mediante terapia génica para la talasemia, la fibrosis quística, algunos tipos de cáncer y la inmunodeficiencia combinada grave ('niños burbuja').
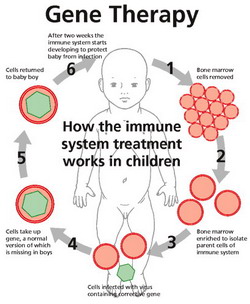 | ||
Ejemplo de terapia génica para 'Niños Burbuja' | ||
Biológicos
Medicina recombinante
Los medicamentos producidos por métodos biotecnológicos son hoy en día parte del botiquín estándar, por así decir. La tabla de abajo muestra un listado de las 13 clases de medicamentos biotecnológicos —también llamados Biológicos— que más se vendieron en el año 2008, sumando un volumen de ventas de más de 80 mil millones de dólares a nivel global.
La producción de antibióticos por fermentación es la manera clásica como conocemos la biotecnología. En este proceso, ciertos microroganismos producen metabolitos secundarios que nosotros utilizamos para combatir infecciones. Estos metabolitos se purifican del cultivo del microorganismo productor y se utilizan tal cual o se modifican químicamente para lograr antibóticos más potentes.
En el caso de los Biológicos, ciertos microorganismos se utilizan como factorías que leen y transcriben la información que les ha sido introducida en su propio genoma en forma de un gen determinado. El resultado es una proteína, la cual puede tener funciones de amplia utilidad para el tratamiento de muchas enfermedades.
En el caso de anticuerpos contra células cancerosas, por ejemplo, éstos en principio podrían ser producidos inyectando los componentes de las células cancerosas que uno quiere combatir en cabras o conejos. Aunque los anticuerpos producidos por estos animales se parecen mucho a los humanos, no son idénticos, lo que significa que nuestro organismo producirá una reacción inmune a estos anticuerpos, lo que en un tratamiento posterior podría ser letal. Este problema se soluciona 'humanizando' los anticuerpos animales. Es decir, se intercambia el código genético de los anticuerpos animales para que éste sea idéntico al humano en los segmentos estructurales del anticuerpo. De esta manera el anticuerpo no es reconocido como extraño. Para el tratamiento, la parte importante son las secciones variables que interactúan con las células cancerosas en este caso. Nuestro organismo está condicionado para tolerar esas secciones variables.
Lo mismo para la insulina, tan importante para el tratamiento de la diabetes. Antiguamente teníamos que utilizar insulina de cerdo, la cual aunque sólo se disgtingue en un aminoácido de la insulina humana, acaba produciendo rechazo inmune. Hoy en día, gracias a la ingeniería genética, son microorganismos quienes producen para nosotros insulina idéntica a la humana, lo que resulta en un producto que quienes sufren de diabetes pueden utilizar toda la vida sin rechazo.
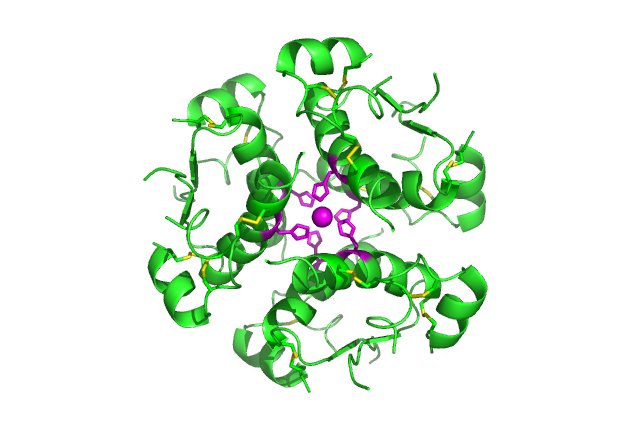 | ||
Modelo tridimensional de un hexámero de insulina. Esta agrupación de seis moléculas de insulina unidas por un átomo de zinc, es la forma como el organismo almacena esta hormona reguladora del metabolismo de carbohidratos y grasas en el cuerpo. | ||
| Clase de Biológico | Ventas 2008 (US$ '000 millones) | Tipo | Para el tratamiento de: |
|---|---|---|---|
| Anticuerpos Anti-TNF | 16.36 | Anticuerpo* | Artritis reumatoide |
| Anticuerpos contra células cancerosas | 15.59 | Anticuerpo | Cáncer metastático colorecetal y de la mama, linfoma |
| Insulina y analógos | 10.90 | Proteína | Diabetes |
| Eritropoietina | 10.05 | Proteína | Anemia renal |
| Interferona beta | 5.35 | Proteína | Esclerosis múltiple |
| Factor Estimulador de Colonias de Granulocitos | 5.18 | Proteína | Neutropenia (post quimioterapia) |
| Factores de coagulación recombinantes | 4.94 | Proteína | Coagulopatías, hemofilia |
| Enzimas | 2.80 | Proteína | Virus sincitial respiratorio humano (para neonatos prematuros); enfermedad de Crohn (autoinmune); enfermedades hereditarias (enfermedades de Fabry y de Gaucher; mucopolisacaridosis; síndrome de Hunter) |
| Hormona Humana de Crecimiento | 2.68 | Proteína | Enanismo |
| Interferona alfa | 2.56 | Proteína | Hepatitis C |
| Anticuerpos Oftálmicos | 1.76 | Anticuerpo | Degeneración macular |
| Hormona Estimulante del Folículo | 1.16 | Proteína | Tratamientos de fertilidad femenina |
| 80.56 miles de millones de dólares | |||
*Tanto los anticuerpos como las proteínas están constituidos de aminoácidos y están codificados en los genes.
Nuevo tratamiento para la leucemia
Reeducando a los linfocitos
Investigadores de la Universidad de Pensilvania reportan en la revista Science Medicine Translational que linfocitos genéticamente modificados de pacientes con leucemia exterminaron las células cancerosas y evitaron su reaparición al menos por un año.
La leucemia es un tipo de cáncer que afecta la sangre y la médula ósea, donde se forman las células sanguíneas, y la enfermedad ocurre cuando las células producidas en la médula se multiplican sin control. Según la Sociedad de Leucemia y Linfoma, en el año 2010 unas 43'500 personas en Estados Unidos fueron diagnosticadas con leucemia, y unas 22'000 murieron a causa de esta enfermedad.
Los investigadores del Centro Abramson de Cáncer y la Escuela Perelman de Medicina, en Pensilvania, probaron un método que consiste en la recolección de células del propio paciente y su modificación genética, para luego retornarlas al cuerpo del paciente sometido a quimioterapia. El método ofrece un tratamiento para otras formas de cánceres, incluidos de pulmón y ovarios, y mieloma y melanoma, según el artículo publicado también en la revista New England Journal of Medicine.
Después de retirar las células del paciente, el equipo investigador las reprogramó para que atacaran a las células del tumor mediante una modificación en la cual usaron un vector de lentivirus. Estos son virus cuyo período de incubación es muy prolongado y de ahí su nombre, que alude a la lentitud con que generam síntomas en su estado natural.
El vector (el virus modificado) codifica una proteína similar a un anticuerpo, llamada receptor antígeno quimérico o CAR por su sigla en inglés, que se expresa en la superficie de los linfocitos o células T y están diseñadas para enlazarse con una proteína llamada CD19. Una vez que los linfocitos empiezan a expresar la proteína CAR, la cual se liga exclusivamente a las células que expresan la proteína CD19, que incluyen las células con leucemia linfática crónica y células B normales, evitando así efectos secundarios, como los causados por la quimioterapia.
Para los pacientes de este estudio la única alternativa hubiese involucrado un trasplante de médula ósea, un procedimiento que requiere una prolongada hospitalización y tiene un riesgo de mortalidad del 20 por ciento. Además, los métodos de cultivo usados reactivan a linfocitos que habían sido suprimidos por la leucemia y estimula la generación de las llamada células T "de memoria", con las cuales los científicos esperan lograr una protección contra la recurrencia del cáncer.
Avances en el tratamiento de la fibrosis quística
Enfoque multidisciplinario entre ciencia básica y aplicada
La fibrosis quística es una grave enfermedad hereditaria que afecta a niños, conduciendo a la acumulación de un espeso moco en ciertos órganos. Hace algunos años, la enfermedad fue considerada como modelo para aplicar la terapia génica, ya que la deficiencia depende de un solo gen. Este tipo de terapia consiste en introducir en pacientes copias normales del gen implicado, para neutralizar el defecto. Desgraciadamente la introducción del gen mediante portadores derivados de virus no funcionó. Una nueva estrategia consiste en buscar medicamentos que permitan a la proteína defectuosa trabajar mejor.
En un artículo aparecido en la versión española de Scientific American de octubre de 2011 bajo el título de “Una bocanada de aire fresco”, los autores SM Rowe, JP Clancy y EJ Sorscher demuestran como, en un esfuerzo interdisciplinario, ellos han llegado a entender las bases moleculares y bioquímicas de las distintas mutaciones que llevan a la fibrosis cística, abriendo de este modo el camino para que investigadores en el área farmacéutica pudieran desarrollar nuevos compuestos químicos, apuntando de manera certera al tratamiento de esta aflicción.
El problema de la fibrosis quística proviene de defectos en el transporte de iones de cloruro, un ion ubícuo en el organismo, a través de las membranas que rodean las células. El gen responsable codifica una proteína implicada en el transporte de los iones de cloruro, y se conoce como “regulador de la conductancia transmembranal de la fibrosis quística” (CFTR, del nombre en inglés). Mutaciones en el gen conducen a que las células carezcan de un canal CFTR operativo, por lo que las personas afectadas producen un moco muy pegajoso y espeso que bloquea las vías respiratorias y facilita las infecciones por bacterias oportunistas. La esperanza de vida antes de la llegada de los antibióticos y del descubrimiento de una terapia nutricional, era de apenas un año.
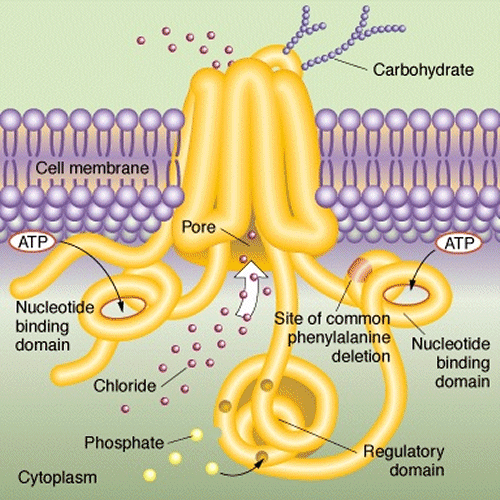
Estructura de la proteína CFTR, transportadora de iones de cloruro a través de membranas, cuyas mutaciones llevan a fibrosis quística.
Los efectos mejor estudiados de mutaciones en CFTR son: (i) el canal no se ubica adecuadamente; (ii) canal truncado que conlleva a una rápida degradación del mismo; y (iii) transporte ineficiente de iones de cloruro. En principio, cada uno de estos defectos necesitaría de un medicamento distinto para su tratamiento.
La ausencia de canales de cloruro en la superficie celular es la mutación genética más frecuente, aunque por lo pronto varias compañías biotecnológicas, tales como Vertex Pharmaceutics y PTC Therapeutics, han logrado avanzar hasta ensayos clínicos para tratar de contrarrestar los otros dos efectos: los canales truncados y los canales no operativos. Los mejores resultados se están obteniendo por lo pronto para los canales no operativos. Tras realizar ensayos con 230,000 compuestos, la compañía Vertex ha descubierto un fármaco que activa de forma selectiva el canal CFTR, recuperando un 50% de su función.
Estos desarrollos demuestran el estrecho lazo entre la investigación básica y la aplicada, ya que sin entender la base de cada uno de los defectos es que el tratamiento de la fibrosis quística descansa en el conocimiento básico de su biología.

